9月5日,宁波大学海洋学院、农产品质量安全危害因子与风险防控国家重点实验室陈炯研究员团队在《Cell》经典子刊《Molecular Cell》发表题为“Consecutive palmitoylation and phosphorylation orchestrates NLRP3 membrane trafficking and inflammasome activation”的最新研究成果,深入解析了顺序性的棕榈酰化和磷酸化修饰调控NLRP3蛋白胞内多重膜结构间动态运输及炎性小体组装与活化的分子机制。

研究成果发表于Molecular Cell杂志
(原文链接:https://www.cell.com/molecular-cell/abstract/S1097-2765(24)00633-6)
NLRP3炎性小体被称为炎症反应的核心,作为固有免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用,一直是生物学领域研究热点之一。它能够感知并响应多种病原体和损伤信号,其活化过程需要NLRP3在细胞内特定膜结构上的精准定位、转运及复合物的组装。然而,NLRP3在不同膜系统之间的高效、有序运输及后续炎性小体的组装与活化机制尚不完全清晰。
该研究首先揭示了由棕榈酰转移酶zDHHC1介导的NLRP3在C130和C958位点的棕榈酰化修饰对其膜定位和运输的重要性。研究表明,NLRP3在这些位点的棕榈酰化修饰使其能够在线粒体、反式高尔基体囊膜(TGN)和内体等多重膜结构之间动态穿梭,并最终转运至微管组织中心(MTOC)—炎性小体组装的关键场所。

进一步的研究发现,除了棕榈酰化修饰介导的NLRP3向MTOC的转运外,NLRP3在到达MTOC后的磷酸化修饰也是炎性小体活化与装配的关键。研究团队发现,LATS1和LATS2蛋白激酶在Priming阶段预先被招募至MTOC,在NLRP3到达后通过磷酸化其S265位点,促进NLRP3构象变化,从而与NIMA相关激酶7(NEK7)相互作用。这一事件解锁了多聚化NLRP3的“笼状”结构,驱动了炎性小体的组装与活化。
同时,研究者还通过小鼠和斑马鱼模型,进一步验证了NLRP3棕榈酰化修饰在进化中的保守性及zDHHC1对NLRP3棕榈酰化修饰功能的重要性。zDHHC1缺失的脓毒血症动物模型炎症反应显著减弱,存活率显著提高,暗示抑制zDHHC1催化的NLRP3棕榈酰化修饰可能成为治疗NLRP3相关炎症疾病的新策略。
综上,该研究系统性地揭示了NLRP3在炎性小体活化过程中复杂的多重翻译后修饰对其膜转运及后续活化的影响,并为NLRP3介导的炎症反应提供了新的治疗靶点。
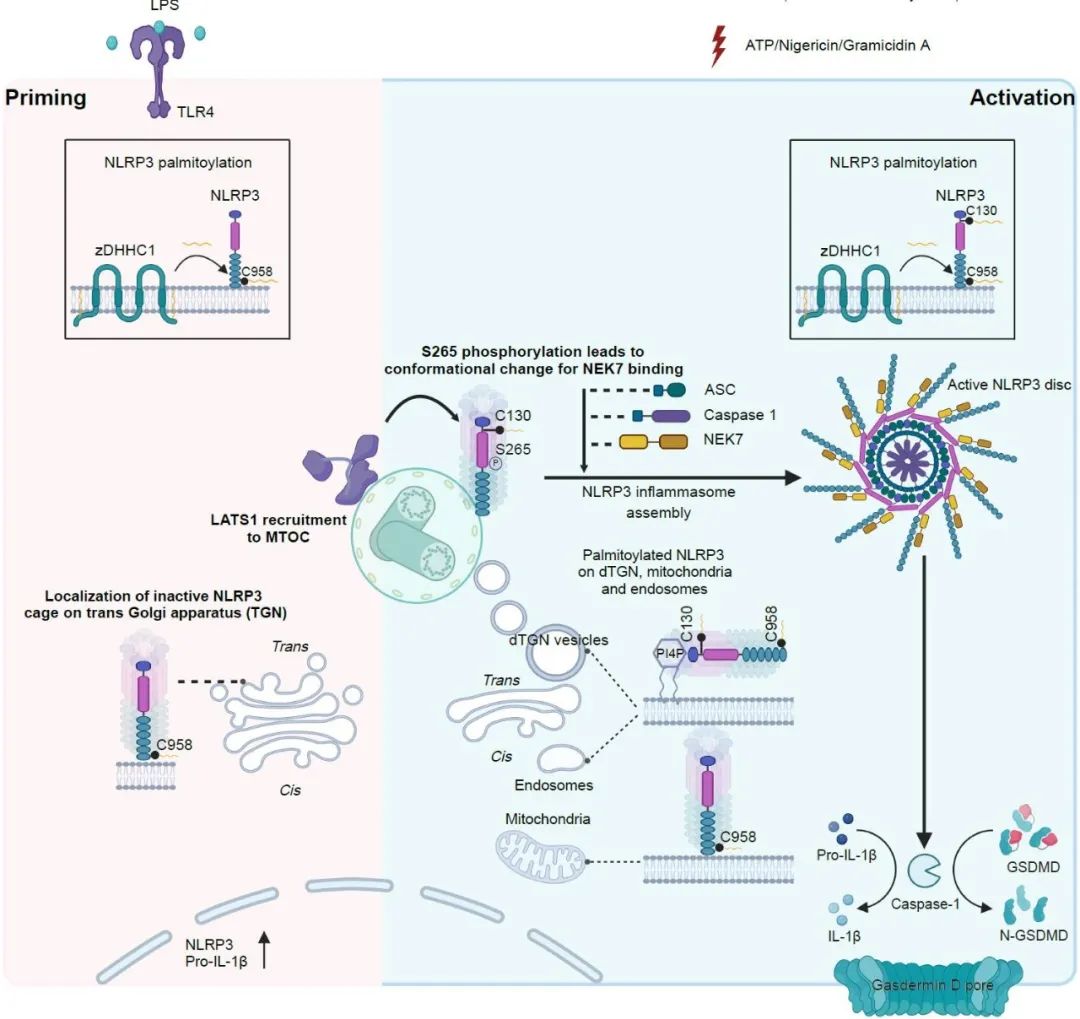
顺序性的棕榈酰化和磷酸化修饰调控NLRP3蛋白胞内多重膜结构间动态运输及炎性小体组装与活化的机制
宁波大学陈炯研究员团队聂力副教授、费辰杰助理研究员、西安交通大学范义增博士及哈佛大学博士后党法斌为该论文的共同第一作者。宁波大学博士研究生赵紫越、朱婷芳、吴翔宇,硕士研究生戴婷、潘婧,助理研究员胡洋,以及哈佛大学罗鸿博教授及博士后Arumugam Balasubramanian为该论文的共同作者。陈炯研究员为该论文的通讯作者和Lead Contact,聂力副教授和哈佛大学魏文毅教授为共同通讯作者。宁波大学为该研究的第一完成单位。该工作得到了国家自然科学基金项目、浙江省自然科学基金项目、宁波市自然科学基金重点项目和农产品质量危害因子与风险防控国家重点实验室高级别科技成果奖培育项目等资助。
中国-博士人才网发布
声明提示:凡本网注明“来源:XXX”的文/图等稿件,本网转载出于传递更多信息及方便产业探讨之目的,并不意味着本站赞同其观点或证实其内容的真实性,文章内容仅供参考。






















